Сегодня — урок по химии 41 – Сложные эфиры. Жиры. Мыла
Сложные эфиры – это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Общая формула сложных эфиров одноатомных спиртов и монокарбоновых кислот:
О
||
R— С – О – R1, где R и R1 — углеводородные радикалы (исключение, эфиры муравьиной кислоты).
Сложные эфиры называют по названиям кислот и спиртов входящих в их состав:
О О
|| ||
Н — С – О – СН3 СН3 – С – О – С5Н11
метиловый эфир муравьиной амиловый эфир уксусной кислоты
кислоты (метилформиат, ме- (амилацетат, пентилэтаноат)
таноат)


метиловый эфир уксусной кислоты, Этиловый эфир уксусной кислоты,
метилацетат этилацетат
Изомерия сложных эфиров обусловлена строением радикалов, связанных с ацилатной группойСложные эфиры широко распространены в природе. Ароматы многих цветов, плодов, ягод обусловлены присутствием в них сложных эфиров. Чрезвычайно распространены в растительном и животном мире относящиеся к сложным эфирам жиры.
Эфиры низших одноатомных спиртов и низших кислот – летучие жидкости с приятным запахом цветов, ягод. Этилформиат имеет запах рома, изоамилацетат – запах груш, этилбутират – запах абрикосов, изоамилбутират – запах ананасов, бензилацетат – запах жасмина и др. Из-за их запаха эти эфиры используются в парфюмерной и пищевой промышленности как «фруктовые эссенции». Эти эфиры мало растворимы в воде, хорошо растворяются в органических растворителях, сами являются растворителями. Температуры кипения сложных эфиров ниже, чем у соответствующих кислот, так как им не присуща ассоциация.
Важнейший способ получения сложных эфиров – взаимодействие карбоновых кислот со спиртами – реакция этерификации.
RCOOH + R’OH ↔ RCOOR’ + H2O.
В качестве катализаторов применяют конц. H2SO4 , газообразный HCl, BF3 и др.
Реакция этерификации обратима. Избыток спирта или кислоты благоприятствует сдвигу равновесия вправо. Увеличить выход эфира можно также постоянным выведением одного из образующихся веществ из сферы реакции. Скорость реакции этерификации зависит от природы спирта и кислоты, а именно – с каким атомом углерода связана гидроксильная группа (первичным, вторичным или третичным) и каково строение углеродной цепи, связанной с карбоксильной группой. Объемистые радикалы создают пространственные затруднения и мешают образованию промежуточных продуктов присоединения. Особенно плохо подвергаются этерификации третичные спирты.
Химические свойства:
1) Действие воды (гидролиз):
R – CO – OR’ + HOH ↔ RCOOH + R’OH
2) Реакцияпереэтерификации:
R – CO – OR’ + R”OH ↔ R – CO – OR” + R’OH
3) Действие аммиака (аммонолиз):
CH3 – CO – OC2H5 + NH3 → CH3 – CO – NH2 + C2H5OH
4) Восстановление
R – CO – OR’ + 2Н2 → R – CH2OH + R’OH
Жиры – это смеси сложных эфиров глицерина и высших карбоновых кислот (ВКК).
В состав растительных и животных организмов наряду с белковыми веществами и углеводами входят жиры и жироподобные вещества. Главной составной частью растительных и животных жиров являются сложные эфиры глицерина и высших жирных кислот – триглицериды пальмитиновой, стеариновой, олеиновой, линолевой и др. Химическая природа жиров бала установлена в первой четверти XIX века Шеврелем. Во всех жирах остаток спирта один и тот же (остаток глицерина): разница между жирами обусловлена остатками кислот. Жиры не имеют резкой температуры плавления и, предварительно размягчаясь, плавятся в определенном интервале температур. Жиры легко растворяются в органических растворителях; они практически нерастворимы в воде, но могут образовывать с ней стойкие эмульсии в присутствии ПАВ (молоко). При длительном хранении на воздухе, под действием влаги и света жиры прогоркают – приобретают неприятный запах и вкус, при этом повышается и их кислотность.
Называют жиры с учетом кислот, входящих в их состав, например:
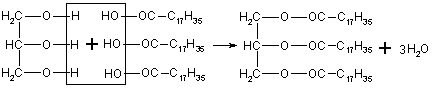
Триглецерид стеариновой кислоты.
Жиры получают главным образом из природных источников – животных и растительных организмов.
К важным химическим свойствам жиров относятся реакции омыления и гидрогенизации:
- Омыление водой (гидролиз).
В промышленности реакция гидролитического расщепления жиров широко используется для получения глицерина и жирных кислот или их солей, т.е. мыла. Расщепление производят как в кислой, так и в щелочной среде.
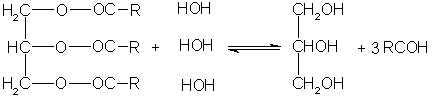
2. Гидрогенизация жиров.
Очень важной реакцией, имеющей промышленное значение, является реакция гидрогенизации жиров – превращение жидких жиров в твердые. Сущность этой реакции состоит в присоединения водорода к непредельным кислотам и превращение их в предельные (Ni, 200°C, 15 кгс/см²):
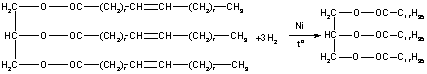
Лучшие сорта гидрированного жира используются для получения маргарина. Маргарин представляет собой эмульсию гидрированного жира, животного жира (говяжьего) или растительного масла в молоке. По виду и запаху продукт напоминает сливочное масло: для придания желтого цвета в него добавляют яичный желток, а для придания характерного запаха – дикетон диацетил СН3СОСОСН3.
Мыла – это соли высших жирных кислот (С10 – С18). Они делятся на растворимые в воде (натриевые, калиевые, аммониевые) и нерастворимые (соли Са, Мg, Ва и т.д.).
Поверхностно-активными веществами (ПАВ) называются вещества, снижающие поверхностное натяжение вследствие адсорбции на границе фаз. К ним относятся в частности мыла и другие синтетические моющие средства, состоящие из полярной гидрофильной части (- СООН, -СООNа, — SО3Nа, — ОН и др.) и неполярной гидрофобной части (углеводородный радикал С10 – С18).
Натриевые мыла являются твердыми, калиевые – жидкими. Чаще всего мыла являются смесью пальмитата натрия – С15Н31СООNа и стеарата натрия – С17Н35СООNа.
Получают мыла по реакциям омыления жиров, а также взаимодействием высших карбоновых кислот с едкими щелочами или гидрокарбонатами:
С17Н35СООН + КОН → С17Н35СООК + Н2О
С17Н35СООН + NаНСО3 → С17Н35СООNа + Н2О + СО2↑
Это был урок по химии 41 – Сложные эфиры. Жиры. Мыла